質量分析
地質学の研究においては、年代決定を目的として、あるいは物質の起源を知るために、いろいろな元素の同位体比測定が必要である。 同位体比の測定は、普通、質量分析計を用いて行われる。 質量分析計を用いた分析を、質量分析という。 質量分析は、有機化学分野において質量スペクトルを測定することにより有機化合物を同定することにも用いられるが、 今回は、元素の同位体比測定という目的にしぼって、解説することにする。
下図は、気体の同位体比を測定するための質量分析計の概念図である。 二酸化炭素の炭素同位体比(13C/12C)を測定する場合を例にとって、この図を説明する。
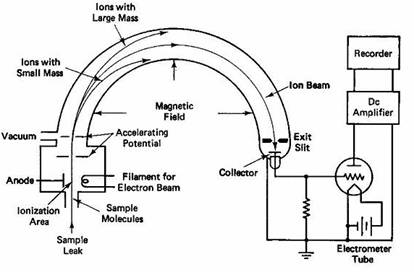
<二酸化炭素の炭素・酸素同位体比の測定>
左下のイオン化室(Ionization Area)に、試料二酸化炭素を導入し、フィラメントから放出される電子をあてて、 二酸化炭素分子をイオン化(CO2+)する。 イオン化した分子は、電位差により加速され、扇形をした分析管中を飛行する。 分析管には磁場がかけられているため、イオン化した分子はローレンツ力をうけ、 円弧をえがいて検出器(Collector)に入る。 このとき、質量の大きい分子はあまり曲げられないが、質量の小さい分子は、大きく曲げられる。 二酸化炭素の場合、質量最大の分子は、質量数49の13C18O18Oであり、 最小の分子は、質量数44の12C16O16Oである。 しかし質量数46,45,44の三種の二酸化炭素イオンの強度を測定すれば、 炭素同位体比(13C/12C)と酸素同位体比(18O/16O)が求まるので、 分析管の端部に、検出器を三個置き、それぞれに、46,45,44のイオンが同時にはいるように、電場と磁場の強さを調節する。 それぞれの検出器にはいったイオンの強度から、 炭素同位体比(13C/12C)と酸素同位体比(18O/16O)が、求まる。
<固体試料、例えば87Sr/86Sr比を求める場合>
加速したイオンを、磁場中に飛行させ、質量ごとに分離させる原理は、気体質量分析計の場合と全く同じであるが、 試料をイオン化させる方法が、気体の場合とは異なっている。 フィラメント上に、 硝酸ストロンチウム(SrNO3)態の試料を塗布し、イオン化室にいれ、真空にしたあと加熱する。 そのことにより、Srがフィラメントから蒸発し、かつイオン化する。 イオン化したSr+は、分析管内に導入され、質量ごとにことなった軌道をえがいて、検出器にはいる。 最新の装置では、検出器が5個以上備えられているので、88,87,86,84のSr同位体を一度に測定できる。 87と86のイオン強度の比が、87Sr/86Srの同位体比である。 ただ、質量数87には、87Sr だけでなく、87Rbも存在する。 したがって、87Srと87Rbの合量を測定することがないように、 あらかじめ、試料溶液を調整するときに、イオン交換樹脂を用いて、試料溶液からRbを除いておく。