試料の採取と調整、試料の分解
地質試料についての試料採取と調製、珪酸塩の分解法試料採取と調製法
合理的な試料採取の方法:地球化学の課題の一つ
「合理的かどうか」は、どのような観点から判断されるか→化学分析を行う目的から
<化学分析の目的>
純物質(鉱物など組成が固定している物質)の化学組成を求める
岩石など、もともと不均質な物質の平均組成を求める
不均質性の程度を調べる
試料採取・調製する上で、最重視すべきこと
分析する試料が、対象物のひな型であること。
採取する試料の量に注意-
玄武岩などの細粒・無斑晶質岩石 ・・・30g位の標本でも岩石全体を代表しうる
-
斑晶の大きい火山岩、ヒン岩、石英斑岩 ・・・100g位の標本が必要。
-
花崗岩ペグマタイト ・・・数kg採取し、それから、分析試料をつくる。
<もともと不均質な対象物の平均組成を求める場合や、 貨物船で運ばれた鉱石試料の平均品位を求めるときに用いられる、 分析試料作成法>
-
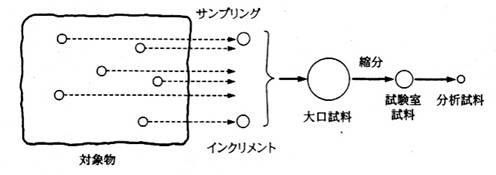
鉱石試料から少量の試料を取り出す。それを、インクリメント(increment)という。 (一回の操作で取り出した少量の試料)下の図参照
-
インクリメントを混ぜて、大容量の試料(大口試料(gross sample) という)をつくる。
-
大口試料を適当な方法により、容量を減じ、試験室試料をつくる。 この操作を、縮分(reduction)という。 縮分法の例として、円錐四分法(別紙参照)や二分器の使用がある。
-
縮分を繰り返し、分析試料を作成する。 (通常10g以下、必要量は、分析方法によって大きく異なる)
-
-
汚染(contamination)をできるだけ防ぐ
- 野外での岩石採取:
- イ 転石からは採取せず、根のある露頭から割って新鮮な部分を採取する。
- ロ 試料から変質した部分を取り除く。
- ハ 岩石薄片を顕微鏡で観察し、変質していないことを確認する。変質していなければ分析試料とする。
- 細粉を作る際
ステンレス乳鉢:乳棒で岩石試料をたたき砕くが、乳鉢の壁を乳棒で直接たたいたり、こすらないようにする。 そうでないと、ステンレス片が試料に混入する。
めのう乳鉢:めのう乳鉢では、ステンレス乳鉢とは違って、乳棒で試料をたたいてはいけない。 メノウが割れ、試料に混入する。めのう乳鉢では、乳棒で摺る。
- 分析の際 試薬の純度に注意
- 試薬:かならず特級の試薬を用いる。
- H2O:必要に応じて(Sr,Ndなどの同位体分析、超微量成分の定量目的)超純水を用いる。
- 服 : 必要に応じてクリーンルームウェアを着用する。
- 野外での岩石採取:
珪酸塩試料の分解法
普通の酸にはとけない岩石などの珪酸塩を分解するには、二とおりの方法がある。
- アルカリ融解
珪酸塩試料に、その10倍量の炭酸ナトリウム(Na2CO3)を加えてよく混合し、 白金ルツボにいれて、強熱(900度C)する。そうすると、
MSiO3 + Na2CO3 → M CO3+Na2 SiO3 (MSiO3:珪酸塩、Mは金属イオンをあらわす)
の反応が右にすすみ、酸に不溶であった珪酸塩MSiO3が、酸に可溶の炭酸塩M CO3に変わる。 融解後は、Na2CO3ガラス中に、M CO3やNa2 SiO3が溶け混ざった状態となる。 そのため融解物は塩酸に溶ける。 この融解物を塩酸に溶かして、種々の金属イオンを含む試料溶液とし、この溶液から、金属イオンを順次分離、定量していく。この分解法は、フッ化水素酸分解法が適用できない成分の定量のとき、岩石の主成分元素の定量の際、に用いられる。
- フッ化水素酸による分解
珪酸塩試料を白金皿にとり、それにフッ化水素酸+硫酸を加え、ホットプレート上にのせ、加熱・乾固させる。 珪酸塩は、フッ化水素酸により分解する。そのときの化学反応は
SiO2 +6HF → H2SiF6 + 2H2Oである。
反応後の溶液を加熱して蒸発・乾固させると、H2SiF6は、気体のSiF4となって空気中に揮散する。
H2SiF6 → SiF4 + 2HF
乾固後の残存物を塩酸に溶解させると、種々の金属イオンが塩酸溶液中にとけこんでいる溶液ができる。 金属イオンはフッ化物となっているので、分析法によってはこの溶液からの分析が不能となるものがあることに注意。 (たとえば、この溶液からキレート滴定によりAlを定量することができない)。 またSiはSiF4として揮散し無くなっているので、定量できない。この方法は、試料を迅速に分解したいとき、微量金属イオンを定量するときに多く用いられる。
フッ化水素酸は、人体に対する腐食性があり、皮膚につけると重度の腐食を起こす。 フッ化水素酸をあつかうときは、ポリエチレン手袋をし、皮膚につけたときは、ただちに流水でよくあらうこと。