重量分析(重量法による硫酸根の分析)
重量分析
重量分析は、分析する試料を秤量したのち溶液にとかし、沈殿などにより目的とする成分を純粋な化合物として分離し、 その重量を測ることにより、試料中の目的成分の定量をおこなう分析法である。 重量分析では、分離した沈殿の重量をはかることにより定量するので、 標準試料を必要としない直接的な分析法であり、化学分析のもっとも基礎となる方法である。 なぜなら、機器分析においては、未知試料が示すある強度を機器を用いて測定し、 濃度が既知の標準試料のそれと比較して未知試料の濃度を求める間接的な分析法であることが普通である。 そのとき、用いられる標準試料の濃度は、究極的には重量分析によって決められたはずであるからである。
沈殿生成の条件
硫酸バリウムBaSO4の沈殿生成を例として
- 硫酸イオンは、バリウムイオンと反応して、微細であるが、重い難溶性の硫酸バリウムの沈殿を作る。
BaSO4 

Ba2+ + SO42- このとき、溶液中の[Ba2+]と[SO42-]の積が、 硫酸バリウムの溶解度積をこえると、硫酸バリウムが溶液から沈殿する。 [Ba2+]、[SO42-]は溶液中でのそれぞれの濃度を表す。
Ksp(溶解解度積)=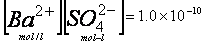 25℃)
25℃)
[Ba2+]×[SO42-] = Ksp 溶液と沈殿が共存する。飽和溶液 [Ba2+]×[SO42-] >Ksp 溶液から沈殿が生じる。 [Ba2+]×[SO42-] <Ksp はじめ沈殿があれば、溶解する。 - その沈殿を熟成させ(粒径の大きくさせて)定量ろ紙(無灰ろ紙)でろ別し、 磁製ルツボ中で焼成してBaSO4の形で秤量する。 (ろ紙は焼成の際、すべてCO2に変え、重量=0とさせる)
- BaSO4の重量からSO4らの重量を計算するには、重量分析係数を用いる。
実験方法
硫酸銅CuSO4の硫酸根(SO42-)の定量
硫酸銅五水和物(CuSO4・5H2O)は青色の結晶で、 天然では、硫化銅鉱床の二次富化酸化帯に産出する(胆ばん、chalcanthite)。
今回は、単純化のため、無水硫酸銅(試薬)を用いる。
- 特級の無水硫酸銅(CuSO4)を0.2~0.25g、薬包紙に正確にはかりとる。
秤量したCuSO4( )g
この中のSO42-のg数 =( )g ×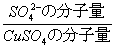 = ( )g ・・ (A)
= ( )g ・・ (A)
このSO42-のモル数 =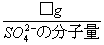 =( )mol
=( )mol
- CuSO4粉末を洗浄した300mlビーカーにいれ、H2Oを50 ml加え、CuSO4を完全に溶解させる。
- 12M HClを2 ml加える。H2Oをさらに加えて、全体で200mlにする。 カスバーナーで、この溶液を加熱し、おだやかな沸騰状態にしておく(ア)
- BaCl2 10%溶液を10mlとり(メスシリンダーで)、空の200mlビーカーにいれる。 H2Oを加えて100mlとし、電気コンロ上で穏やかに沸騰するまで加熱する。(イ)
- (イ)BaCl2溶液を、(ア)のCuSO4溶液へ、少しずつ、かき混ぜながら加える。 (白い沈殿が生じる) (ウ)
名称_______ 化学式_______
問2 この物質の1molは何gか。1mol = _______g
問3 (ウ)の溶液中のBa2+濃度を仮に0.016 mol/lとする。 BaSO4のKsp=1.0×10-10から、 (ウ)の、沈殿BaSO4と共存している溶液中のSO42-濃度を求めよ。
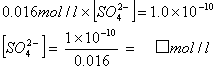
(ウ)のビーカーを、湯浴上にのせ、1時間加熱し、沈殿を熟成させる。
ロートに無灰ろ紙(No.5C、またはNo.7)をつけ、ロート台にのせ、下に500mlビーカーをおく。 まず、(ウ)のビーカーの中の上ずみ液のみをろ過する。最後に、沈殿をろ紙上にうつす。
ビーカーを少量の水でよく洗い、洗液もろ過する。 ろ紙上の沈殿に温湯を注ぎ、Cl-イオンを完全に除去する。(5~6回)
<これ以降次回での実習>
- 洗浄のおわった沈殿を、ろ紙ごと、すでに恒量にしてある磁製るつぼに移し、 ルツボを電気コンロ上にのせ、ろ紙を乾燥させ、さらに炭化させる。
- ルツボをマッフル炉上にのせる。
- 弱い酸化炎で熱しはじめ、ろ紙を完全に炭化させ、その後、炎を強くしてろ紙を灰化させる(ろ紙をもやさないように注意)。
- ろ紙が灰化したら、ルツボのそこが赤くなるくらい(900℃)強熱し、ろ紙をCO2にして逸散させる。
- 灰がすべてなくなったら、ふたを閉じ、さらに10分間、強熱する。 強熱し終わったら、ルツボをデシケータにうつし、30分間放冷する。
問 生成した物質の名称________と、化学式________。
ルツボを電子天秤で秤量する。 ____ g
全重量 □ - □るつぼの重量 = □沈殿のみの重量g
![]() ・・・(B)
・・・(B)