容量分析(キレート滴定によるCaの定量)
<容量分析とはどのような分析法か>
酸-塩基の中和反応を例として、容量分析の原理を説明する0.1mol/lのHClをビューレットにいれる
三角フラスコの中に、総量0.001molとなるよう、NaOH水溶液を入れるex(0.1mol/lのNaOH水溶液を( )ml分取すればよい)
反応式 ( )+( )→( )+( )
(中和は指示薬フェノールフタレイン(ピンク→無色)の色の変化から知る)
中和するまでに、0.1mol/l HCl液をxml要した、とする。
xmlに含まれる、HClの総物質量=![]()
□HClの物質量mol=□NaOHの物質量mol
x=□ml
である。
溶液間反応の種類
- 酸-塩基の中和
- 錯体形成(キレート形成)*
- 酸化還元
キレート滴定
エチレンジアミン四酢酸(EDTA、H4Yと略記)は、水溶液中で金属イオンと反応し、 非常に安定な金属キレート化合物を作る。 キレート滴定は、そのことを利用した容量分析法である。キレート生成反応は、
![]()
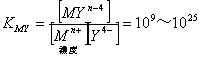
したがって、金属イオンを含む試料溶液にEDTA溶液を滴下していくと、 当量点*において、溶液中の[Mn+](濃度)が急激に減少する。 (ほとんどMYn-4になってしまう)
*当量点:滴定の際、もとの金属イオンのモル数と、EDTAのモル数が等しくなる時点、終点)
その当量点を、金属指示薬*の変色により認知する。
*金属指示薬:金属キレート化合物の一種で、金属キレート型のときと、遊離型のときでは、色が違う。
変色の原理
EDTA滴定の際、当量点では、Mn+濃度が急激に減少するので、Y4-が過剰となる。 そのため、Y4-は、金属キレート型金属指示薬から、金属をぬきとり、金属指示薬を遊離型にさせる。 そのため、変色する。
キレート生成反応の際、金属イオンとEDTAは1:1で反応し、その比は金属の原子価によらない。 (したがってEDTA溶液の濃度はモル濃度で表す)
実験操作
キレート滴定によるCa2+の分析(1)試料 ・・・ 沈降製CaCO3(式量:100.09)
試料0.16g(前後)を、薬包紙に正確にはかりとる。(15人分の試料)
□小数5桁g、CaCO3のモル数=
![]()
秤量したCaCO3を、100mlビーカーにいれ、 H2O 20ml、6M HCl 10mlを少しずつ加え、完全にとかす。
この溶液を200mlメスフラスコにうつす。(メスフラスコの内部は濡れていてよい)。
空になったビーカーに、純水20mlをいれて、内壁を洗い、その洗液を200mlメスフラスコにいれる。
この操作を繰り返し、全部で3回行う。
最後にメスフラスコに純水を加え、200mlに正確に調節しよく混合する。
200mlの三角フラスコを用意する(内部は濡れていて良い)。
洗浄済みで、内部が乾いている10mlホールピペットを用いて、
200mlメスフラスコ中の溶液10mlを分取し、三角フラスコにいれる。
三角フラスコに入っているCa2+のモル数=![]() …(ア)
…(ア)
*有効数字3桁、@.@@×10-n
この三角フラスコに純水80mlを加え、8M KOH溶液5mlをくわえる。
次に、NN希釈粉末をひとさじ加える。(赤色に発色)
赤から青へ変色し、赤みが完全に消えたところ(スカイブルー)が終点 …V0 mlとする。
三角フラスコに入っているCa2+のモル数
- (ア)と(イ)の結果を比較せよ。 また、この二つのデータを提出せよ。
-
- 問1 200mlメスフラスコ中のCa2+濃度は、何%か。 またそれは、何ppmか。(小数点以下2桁までの数値で記述)
- 問2 CaCO3の理想化学組成を、次の2通りの表し方で、重量パーセントにより表せ
(小数点以下2桁までの数値で記述)。
原子量は以下のとおり
C:12.01、O:16.00、Ca:40.08
元素組成
酸化物組成 (岩石学では、こちらを用いる(主成分に関して))Ca _____% C _____% O _____%
CaO _____% CO2 _____% - 問3 菱鉄鉱固溶体(Fe0.65Mn0.05Mg0.2Ca0.1)CO3の化学組成を、
各元素の酸化物の重量パーセントとして表せ(小数点以下2桁までの数値)。
原子量は以下のとおり
C:12.01、O:16.00、Fe:55.85、Mn:54.94、Mg:24.31、Ca:40.08
FeO _____% MnO _____% MgO _____% CaO _____% CO2 _____%
(2) 試料 ・・・ 水道水、源池の井戸水、ミネラルウォーター(evianなど)
- 水道水100mlを、100mlメスフラスコに正確に採る。
- その水を200または300 ml の三角フラスコに移す。
- 8M KOH溶液2mlをくわえる。
- NN希釈粉末をひとさじ加える。(赤色に発色)
三角フラスコに入っているCa2+のモル数
(ウ)の物質量は、Ca2+として何gであるのか。 □g ・・・(エ)
(エ)が水道水100ml中に存在するのだから、
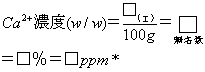
*小数点以下2桁まで