溶液の濃度とその表し方
1.原子量と分子量
定義・説明
原子量は質量数12の炭素同位体(
![]() )の質量を12とした時の、他の元素の相対的質量である。
したがって、原子量は無次元で単位はない。
分子量はその分子を構成している原子量の和として表すことができる。
これを形式的に示すと次のようになる。
)の質量を12とした時の、他の元素の相対的質量である。
したがって、原子量は無次元で単位はない。
分子量はその分子を構成している原子量の和として表すことができる。
これを形式的に示すと次のようになる。
分子量=∑(構成原子の原子量)
原子量が無単位なので、分子量にも単位がない。
例題1
二酸化炭素(CO2)の分子量を求めよ。ただし、原子量は以下の通りC:12.01,O:16.00
<解>1×12.01 + 2×16.00 = 44.01
<答> 44.01
2.モル
定義・説明
原子や分子、イオンなど同一種類の粒子 6.02×1023個(アボガドロ数)の集団を1モル(mol)とする。 1 molあたりの質量を、その物質(粒子)のモル質量をいう。 モル質量は、原子量、分子量などの数字に単位(g/mol)をつけたものと等しい。例題2
二酸化炭素(CO2)1モルは何gか、またその分子1個は何gか。<解>44.01g
<答>
![]()
3.容量モル濃度
定義・説明
容量モル濃度
溶液1000ml中に含まれる溶質の物質量(mol)を表す。 記号はM=(=mol/dm3または mol/l)を用いる。
M=

M=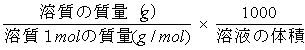
M=
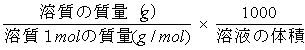
例題3
ブドウ糖C6H12O6 の1mol/l 水溶液が200mlある。この中にはブドウ糖が何g 含まれているか。ただし、原子量は以下の通り。 H:1.01, C:12.01, O:16.00
<解>
1 l中に1mol含まれているのだから、1l中には
6×12.01+12×1.01+6×16.00=180.18g
200ml中には、
![]() =36.04g
=36.04g
4.質量百分率濃度
定義・説明
質量百分率濃度(w/w)%
溶液100g 中に含まれる溶質の質量(g)をパーセントで表したもの。 溶質の質量をW、溶媒の質量をWsとすると
(w/w)% =(W/(Ws+W))×100
例題4
濃塩酸は比重1.19で、37.2%の塩化水素を含む。濃塩酸1l中には何gのHClを含むか。 またこの塩酸は何mol/lか。 原子量がH:1.01,Cl:35.45
<解>
1000×1.19=1190g
1190×0.372=442.7g
HCl(442.7gのHClを含む。)
![]() =12.1 mol
=12.1 mol
12.1 mol/l
5.百万分率濃度(ppm)
定義・説明
ppm parts per millionの略。百万分率。溶液の濃度をppmで表す場合は、
ppm=
希薄水溶液では、密度を1g/mlとして溶液の質量を求める。
例題5
25.5μlの血清に1.2μgのK+イオンが含まれていた。何ppmか。
<解>
1.2μg=1.2×10-6g
25.0μl=25.0×10-6
l=25.0×10-6×103
ml1ml=1g
だから、
25.0μl=25.0×10-3g
K+の濃度
=
![]() =
=
![]() =48×10-6
=48×10-6
<答>48 ppm